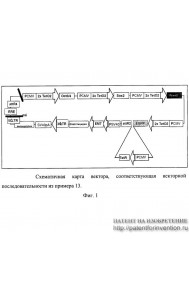
Способы получения и применения мультипотентных клеточных популяций
Патент обеспечивает охрану способу получения плюрипотентных клеток, включающему этапы, на которых: - выбирают неплюрипотентные соматические клетки; - вводят или сверхэкспрессируют белки или последовательности, содержащие одно или более из «длинной» (Prr+) изоформы numb, Oct4, Sox2 и Nanog; - выращивают выбранные клетки в питательной среде, содержащей цитокины; и - поддерживают клетки в данных условиях культивирования до тех пор, пока не достигают желаемое количество плюрипотентных клеток.
Кроме того, патент распространяется на плюрипотентные клетки, полученную с помощью вышеуказанного способа.
Далее, патент охватывает применение популяции вышеуказанных клеток в скрининге на основе клеточного специфического маркера, трансгенного маркера экспрессии под управлением клеточных специфических стимуляторов или трансгенного маркера экспрессии под управлением стимуляторов, связанных с нейротрансмиттером.
Также, патент охраняет способ лечения пациента с состоянием или заболеванием:
a. облегчаемым коррекцией генетически обусловленной недостаточности;
b. зависящим от экспрессии генов, ответственных за подверженность;
c. облегчаемым возобновленной пролиферацией клеток; или
d. характеризуемым как дисплазия, рак или аберрантное поведение клеток,
включающий введение указанному пациенту терапевтически эффективного количества клеток по п.15.
Формула изобретения
1. Способ получения плюрипотентных клеток, включающий этапы, на которых:
- выбирают неплюрипотентные соматические клетки;
- вводят или сверхэкспрессируют белки или последовательности, содержащие одно или более из «длинной» (Prr+) изоформы numb, Oct4, Sox2 и Nanog;
- выращивают выбранные клетки в питательной среде, содержащей цитокины; и
- поддерживают клетки в данных условиях культивирования до тех пор, пока не достигают желаемое количество плюрипотентных клеток.
2. Способ по п.1, отличающийся тем, что используемая(ые) нуклеиновая(ые) кислота(ы) или белок(белки) содержит(ат):
a. Prr+ изоформу Numb;
b. Prr+ изоформу Numb и один из: LIF, ген с LIF-активностью, LIFR, онкостатин M, рецептор онкостатина M, кардиотропин-1 и CNTF;
c. Prr+ изоформу Numb и Notch;
d. Prr+ изоформу Numb, OCT3/4, SOX2 и Notch;
e. Prr+ изоформу Numb, OCT3/4, SOX2, NANOG и Notch;
f. Prr+ изоформу Numb, OCT3/4, SOX2, NANOG и трансген с LIF-активностью;
g. Prr+ изоформу Numb, OCT3/4, SOX2, NANOG и множественные трансгены с LIF-активностью;
h. такие, которые выбраны из кодирующих длинную Prr+ изоформу Numb, NANOG, OCT3/4, SOX2, трансгены с Notch-активностью, Hoxb4, FGF-4, LIF, LIFR, CNTF, онкостатин, рецептор онкостатина, кардиотропин-1, IL-6, IL6R, гипер-IL-6, IL-11, gp130 и другие трансгены с LIF-активностью;
i. Prr+ изоформу Numb и выбранные из LIF, LIFR, онкостатин-M, кардиотропин-1, IL-11, IL-6, IL6R, гипер-IL-6, LIFR, gp130 и FGF-4; и один или более из OCT3/4, SOX2, NANOG и FGF-4;
j. такие, которые выбраны из LIF, LIFR, онкостатин-M, кардиотропин-1, IL-11, IL-6, IL6R, гипер-IL-6, LIFR, gp130 и FGF-4; и один или более из ОСТ3/4, SOX2, NANOG и FGF-4;
k. Prr+ изоформу Numb и FGF-4;
l. FGF-4.
3. Способ по п.2, отличающийся тем, что «длинную» (PRR+) изоформу numb, кодирующую последовательность нуклеиновой кислоты или белок:
a. дополняют другими последовательностями нуклеиновых кислот или белками, включая последовательности нуклеиновых кислот или белки из группы, включающей кодирующую человеческий LIF, онкостатин M, кардиотропин-1, IL-11, IL-6, IL6R, гипер IL-6, LIFR, gp130, ОСТ3 (ОСТ4), NANOG, SOX2 и/или FGF-4; или
b. заменяют трансфекцией на другие последовательности нуклеиновых кислот или белки, включая последовательности нуклеиновых кислот или белки из группы, включающей кодирующую человеческий LIF, онкостатин M, кардиотропин-1, IL-11, IL-6, IL6R, гипер IL-6, LIFR, gp130, ОСТ3 (ОСТ4), NANOG, SOX2 и/или FGF-4.
4. Способ по п.1, отличающийся тем, что выбранную клетку модифицируют для экспрессии:
а. теломеразы, изменяющей срок жизни клетки;
b. продукта гена, отсутствующего у человека;
c. последовательности нуклеиновой кислоты, кодирующей белок, выбранный из аспартоацилазы (ASP), HRPT, HTT, NPC1, GBA, PARK2, VHL, бета-глюкуронидазы, гексозаминидазы А (НЕХА), гексозаминидазы В (НЕХВ), HRPT, HTT, альфа-галактозидазы (GLA), кислой бета-глюкозидазы (GBA), супрессора опухоли фон Гиппеля-Линдау (VHL), бета-глобина (НВВ), NPC1, PARK2.
5. Способ по п.1, отличающийся тем, что выбранную клетку или ее потомство модифицируют для экспрессии:
a. существенных последовательностей нуклеиновых кислот;
b. синтетических олигонуклеотидов, комплементарной РНК (siRNA), малой РНК, образующей шпильки (shRNA), малой интерферирующей РНК, антисмысловой РНК;
c. последовательности нуклеиновой кислоты или белка, замедляющей(его) инфицирование вирусом;
d. последовательности нуклеиновой кислоты или белка, воспроизводящей(его) указанные клетки и/или их потомство, менее способные поддерживать репликацию вируса;
e. последовательности нуклеиновой кислоты или белка, воспроизводящей(его) указанные клетки и/или их потомство, менее способные поддерживать транскрипцию вируса;
f. синтетического олигонуклеотида, направленного против корецептора вируса иммунодефицита;
g. РНК-ловушки;
h. psi-последовательности ВИЧ;
i. последовательности нуклеиновой кислоты или белка, воспроизводящей(его) указанные клетки и/или их потомство, сопротивляющиеся заболеванию.
6. Способ по п.1, отличающийся тем, что указанную выбранную клетку и/или ее потомство инкубируют в питательной среде, содержащей цитокины, выбранные из группы, включающей EGF, bFGF, LIF, стальной фактор, IL-6, гипер IL-6, IL-7, онкостатин M, кардиотропин-1 и другие цитокины, повышающие рост.
7. Способ по п.1, отличающийся тем, что указанную выбранную клетку и/или ее потомство дифференциируют сверхэкспрессией или введением нуклеиновой(ых) кислоты(т) или белка(белков), соответствующих одному или более транскрипционному фактору, обычно присутствующему в целевых клетках.
8. Способ по п.1, отличающийся тем, что указанные клетки и/или их потомство дополнительно сверхэкспрессируют транскрипционный фактор белков или нуклеиновых кислот, выбранных из группы, включающей:
a. Mash1 (Ascl1) или их часть;
b. MyoD, миогенин, Myf5, Myf6, Mef2, миокардин, Ifrd1, транскрипционный фактор мышечных клеток и/или последовательность, кодирующую специфический для клеток мышечного типа bHLH или ее часть;
c. Foxa2, Sox17, HLXB9 и/или Pdx1 или их части;
d. печеночный ядерный фактор (HNF)-1, HNF-3, HNF-4, HNF-6 и/или CREB-связывающий
белок или их части;
e. Runx1/AML1 и/или NOV (CCN3) или их части;
f. Sox9, CREB-связывающий белок, Gata6 и/или Runx2 или их части;
g. OLIG1, OLIG2 и/или Zfp488 или их части;
h. MyoD, миогенин, миокардин, Myf5, Myf6, Mef2A, Gata4, Gata5 и Gata6 или их части;
i. Gata4, Gata5 и/или Gata6 или их части;
j. Миокардин или его часть;
k. Миогенин и MyoD или их части;
l. Runx2 или его часть;
m. Mash1 (Ascl1), Ngn2, Nurr1, Lmx1b и/или Ptx-3 или их части;
n. Mash1 (Ascl1), Phox2b, Lmx1b, Nkx2.2, Pet1, Gata2, Gata3 и/или Pet1 или их части;
o. Mash1 (Ascl1), Phox2a и/или REST4 или их части;
p. Mash1 (Ascl1), PITX2, Dlx2, Dlx5, искусственных олигонуклеотидов, целенаправленно воздействующих на HES1, Phox2a и/или REST4 или их части;
q. Mash1 (Ascl1), Phox2a, Phox2b, dHand, Gata2 и/или Gata3 или их части;
r. Mash1 (Ascl1), Nurr1, REN, нейрогенин 1, нейрогенин 2, нейрогенин 3, Mash1, Phox2b, Phox2a, dHand, Shh, FGF8, Lmx1b, Nkx2.2, Pet1, Lbx1, Rnx, Gata3 и/или антисмысловая РНК Hes1 или их части;
s. PRR-Numb или его часть; или
t. Numblike или его часть.
9. Способ по п.1, отличающийся тем, что указанные клетки и/или их потомство инкубируют в дифференцирующей среде.
10. Способ по п.1, отличающийся тем, что указанные клетки и/или их потомство инкубируют в дифференцирующей среде, включающей одно или более средств, выбранных из группы, включающей:
a. ретиноевую кислоту, нейротрофин 3 (NT3), фактор роста нервов (NGF), фактор роста, полученный из клеточной линии глии (GDNF) и/или интерферон-γ (IFN-γ), гексаметилен-бис-акриламид, диметилсульфоксид (DMSO), фетальную бычью сыворотку (FBS), нормальную бычью сыворотку (NBS), ретиноевую кислоту, кондиционированную среду для кардиомиоцитов, фактор роста эндотелия сосудов (VEGF), LIF, тромбопоэтин, колониестимулирующий фактор, M-CSF (CSF-1), GMCSF, IL-7, цитокин, стимулирующий CD4+ Т-клеточную дифференцировку, маслянокислый натрий, активин А, фактор роста эпидермиса, основной фактор роста фибропластов, ноггин, инсулиноподобный фактор роста и никотинамид;
b. ретиноевую кислоту, нейротрофин 3 (NT3), фактор роста нервов (NGF), фактор роста, полученный из клеточной линии глии (GDNF) и/или интерферон-γ (IFN-γ);
c. гексаметилен-бис-акриламид или диметилсульфоксид;
d. фетальную бычью сыворотку (FBS);
e. нормальную бычью сыворотку (NBS), диметилсульфоксид, ретиноевую кислоту и/или кондиционированную среду для кардиомиоцитов;
f. фактор роста эндотелия сосудов (VEGF), тромбопоэтин и колониестимулирующие факторы, соответствующие типу целевой клетки;
g. LIF, нейротрофин 3 (NT3) и/или фактор роста нервов (NGF);
h. колониестимулирующий фактор, факультативно M-CSF (CSF-1), GM-CSF, IL-7 или цитокин, стимулирующий CD4+ Т-клеточную дифференцировку; и
i. маслянокислый натрий, активин A, ретиноевую кислоту, фактор роста эпидермиса, основной фактор роста фибропластов, ноггин, инсулиноподобный фактор роста II и никотинамид.
11. Способ по п.1, отличающийся тем, что белок, нуклеиновая кислота или средство присутствует для скрининга в отношении его способности индуцировать фенотические изменения или дифференцировки выбранных клеток в целевые популяции клеток.
12. Способ по любому из пп.1-11, отличающийся тем, что указанную клетку и/или ее потомство культивируют в трехмерной или двухмерной подложке, причем указанные клетки и/или их потомства выращивают в бесклеточном органе или на бесклеточной ткани, или указанные клетки или их потомства используют в комбинации с технологией чернильной печати для тканевой инженерии.
13. Способ по п.1, отличающийся тем, что его осуществляют in vivo.
14. Способ по п.1, отличающийся тем, что используют электропорацию, липосомы, нанокапсулы, нанохранилища и/или другие подходы, недопускающие ретровирусное/лентивирусное объединение, или любую случайную замену генома указанной клетки, включая сайт-направленный мутагенез.
15. Плюрипотентная клетка, полученная от пациента или донора, для применения в сферах, использующих клеточную терапию, генную терапию или в животноводческом хозяйстве, полученная с помощью рекомбинантных способов по пп.1-14.
16. Применение популяции клеток по п.15 в скрининге на основе клеточного специфического маркера, трансгенного маркера экспрессии под управлением клеточных специфических стимуляторов или трансгенного маркера экспрессии под управлением стимуляторов, связанных с нейротрансмиттером.
17. Способ лечения пациента с состоянием или заболеванием:
a. облегчаемым коррекцией генетически обусловленной недостаточности;
b. зависящим от экспрессии генов, ответственных за подверженность;
c. облегчаемым возобновленной пролиферацией клеток; или
d. характеризуемым как дисплазия, рак или аберрантное поведение клеток,
включающий введение указанному пациенту терапевтически эффективного количества клеток по п.15.